*仅供医学专业人士阅读参考华泰配资
PTEN失活突变通过激活PI3K/AKT通路,导致ER+复发时转化为三阴性表型,为靶向干预提供新策略。
乳腺癌是女性常见的恶性之一,其中约70%的乳腺癌表达雌激素(ER)或孕激素(PR)受体,且无HER2过表达,即ER+/HER2−乳腺癌[1]。这类乳腺癌通常生长较缓慢,但约20%-30%的患者在复发时会出现激素受体(HR)状态从阳性转为阴性的情况,这种转变与较差的临床结果相关,对治疗决策和抗肿瘤疗法的有效性有重要影响[2-4]。然而,导致这种转换的机制尚未完全明确。
2025年发表在《
Breast Cancer Research and Treatment》杂志中的一篇研究描述了ER+/HER2−乳腺癌患者在复发时转化为三阴性表型的临床和病理特征,并探讨了乳腺癌进展过程中HR丢失相关的分子改变 [5] 。本文精粹研究相关内容,以飨读者。
研究设计
研究者通过机构回顾性地确定了112名患有原发ER+/HER2−乳腺癌并出现局部或远处复发的患者。根据复发肿瘤的受体特征将患者分为两组队列:不一致的三阴性乳腺癌(TNBC,n=20)和一致的ER+/HER2−肿瘤(n=92)。收集的临床和病理变量包括肿瘤组织学、肿瘤分级、pT、pN、在原发和复发肿瘤中ER、PR、HER2的表达以及辅助治疗史等。
在分子分型方面,85%的患者在耶鲁-纽黑文医院进行了Oncomine下一代测序(NGS)肿瘤分析,其余患者进行了基因检测。此外,还对肿瘤浸润淋巴细胞(TILs)和程序性细胞死亡配体1(PD - L1)的表达进行了分析。
研究结果
1 临床病理特征
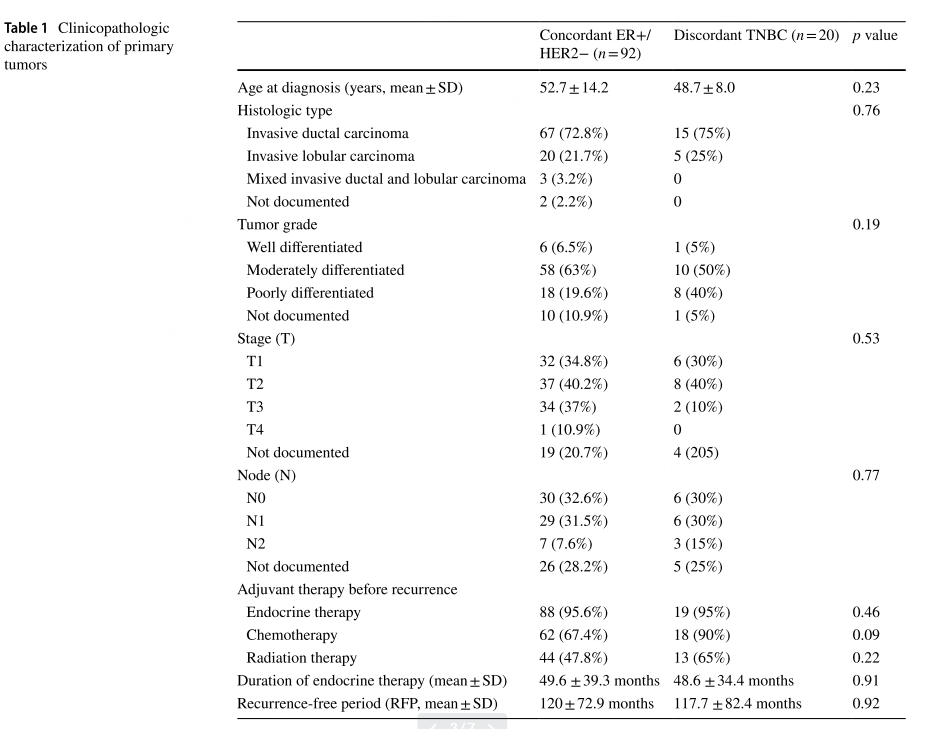
两组队列在患者年龄、肿瘤类型、分级、分期及肿瘤复发前的治疗史等临床病理特征方面显示出相似性。在不一致TNBC肿瘤中,75%为浸润性导癌管,其中50%为中分化,40%为低分化;一致ER+/HER2−队列中,72.8%为浸润性导管癌,63%为中分化,19.6%为低分化。初始肿瘤阶段(pT、pN)在两组之间也无显著差异,主要为pT1、pT2和pN0、pN1。
表1 原发性肿瘤的临床病理特征华泰配资
2 分子特征
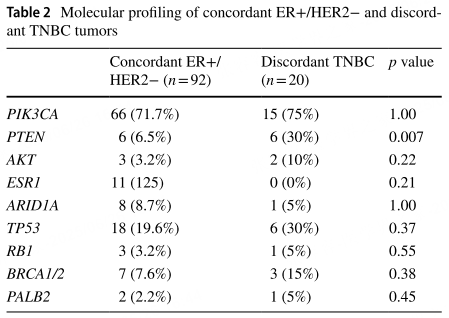
与一致ER+/HER2−肿瘤相比,不一致TNBC肿瘤具有更高的PTEN突变患病率(30% vs 5.5%,p=0.007)。不一致TNBC肿瘤中的特异性PTEN突变包括G20Ter、R130Q、Q245Ter、Q298和T319Ter,一致ER+/HER2−肿瘤中的PTEN突变包括G20Ter、E106Ter、G165fs、Q171Ter、T319Ter和1-2号外显子缺失,这些突变大多是破坏性的,导致肿瘤抑制功能丧失。
表2 一致性ER+/HER2-和不一致性TNBC肿瘤的分子分析
3 TILs和PD-L1在复发/转移性肿瘤中的表达
TILs按照国际TILs工作组指南进行评估,并分为4组:阴性(<1%)、低(1-20%)、中级(21-40%)和高(>40%)。两组间TIL水平无显著差异。在不一致TNBC肿瘤和一致ER+/HER2−肿瘤中,33.3%的病例中均观察到PD-L1蛋白表达。这些发现表明,尽管生物标志物在复发时转换为TNBC,但通过TILs和PD-L1表现的免疫微环境仍保持相对稳定。
4 治疗和无复发生存期
在首次复发之前,两组的患者几乎都接受了辅助内分泌治疗。与一致ER+/HER2−患者相比,不一致TNBC患者接受了化疗(90% vs 67.4%)和放疗(65% vs 47.8%)的比例更高,但差异无统计学意义。两组的内分泌治疗持续时间相似,一致ER+/HER2-和不一致TNBC患者组平均分别为49.6±39.3个月和48.6±34.4个月(P=0.91)。从初始诊断到转移性TNBC的平均记录时间为148个月。在20例不一致的TNBC患者中,有5例在转移性TNBC诊断之前就存在间隔转移性疾病,且所有间隔转移性疾病在TNBC患者中ER和/或PR的染色百分比相较于相应的原发肿瘤均有下降。
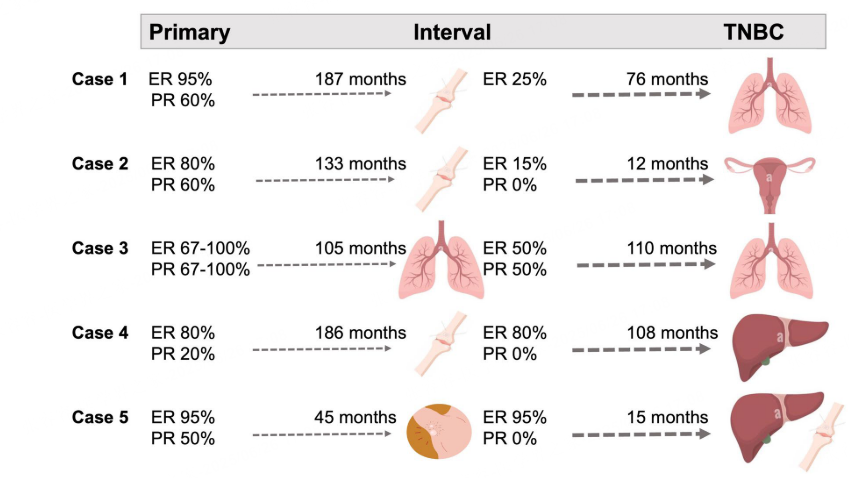
图1 5例间期转移不一致TNBC患者HR+到HR-状态的演变
研究结论
PI3K/AKT/PTEN通路是多种癌症类型中最易改变的信号通路之一,在大约一半的ER+/HER2−乳腺癌病例中,尤其是在癌症复发时会出现该通路过激活现象。PTEN基因是一种肿瘤抑制基因,编码具有脂质和蛋白磷酸酶活性的双特异性磷酸酶,其通过去磷酸化PIP3为PIP2来抑制AKT激活和下游信号传导过程。在本研究中发现,PTEN失活突变与HR+/HER2−乳腺癌复发期间的HR丢失相关,且大多数PTEN突变是已知的可损害或消除肿瘤抑制功能的破坏性突变。这些发现与临床前数据一致,即在ER+乳腺肿瘤中,PI3K信号的激活与较低的ER和PR水平以及luminal B亚型相关[6]。通过PI3K/AKT/PTEN通路信号的增加可能有助于复发肿瘤向激素不依赖的转变。PTEN突变状态可能作为肿瘤进展的预后和预测标记,有助于指导治疗选择。
此研究揭示了PTEN失活突变与乳腺癌复发时HR丢失之间的相关性,为了解乳腺癌复发过程中肿瘤生物学的变化提供了新的视角,也为未来开发分子预测因子以精准筛选患者并实施适当和有益的治疗提供了理论基础。然而,研究存在几个局限性:首先,其研究为回顾性设计;其次,不一致TNBC患者队列规模相对较小,且缺乏原发肿瘤的配对分子数据;此外未对PTEN蛋白表达和下游信号通路的异常进行检测。
总之,这项研究强调了在ER+/HER2−乳腺癌复发中PTEN在激活突变与HR丢失之间的关系,为乳腺癌的精准治疗和预后判断提供了潜在的新靶点和生物标志物,但其结果仍需在更大规模的患者队列中进行验证。
参考文献:
[1].Howlader N, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst. 2014;106(5):dju055. Published 2014 Apr 28.
[2].Schrijver WAME, et al. Receptor Conversion in Distant Breast Cancer Metastases: A Systematic Review and Meta-analysis. J Natl Cancer Inst. 2018;110(6):568-580.
[3].Lindström LS, et al. Clinically used breast cancer markers such as estrogen receptor, progesterone receptor, and human epidermal growth factor receptor 2 are unstable throughout tumor progression. J Clin Oncol. 2012;30(21):2601-2608.
[4].Aurilio G, et al. A meta-analysis of oestrogen receptor, progesterone receptor and human epidermal growth factor receptor 2 discordance between primary breast cancer and metastases. Eur J Cancer. 2014;50(2):277-289.
[5].Zhan H, et al. PTEN inactivating mutations are associated with hormone receptor loss during breast cancer recurrence. Breast Cancer Res Treat. 2025;211(2):441-447.
[6].Creighton CJ, et al. Proteomic and transcriptomic profiling reveals a link between the PI3K pathway and lower estrogen-receptor (ER) levels and activity in ER+ breast cancer. Breast Cancer Res. 2010;12(3):R40.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考
审批编号:CN-162731,过期日期:2026-01-11
*“医学界”力求所发表内容专业、可靠,但不对内容的准确性做出承诺;请相关各方在采用或以此作为决策依据时另行核查。
巧牛配资提示:文章来自网络,不代表本站观点。